近日,南方医科大学南方医院普外科李国新、邓海军教授团队在世界优秀胃肠病学杂志《GUT》(SCI分部)在线发表题为“论肿瘤——CD8+T细胞”的文章1、中国科学院)。 -》原创科研论文。该研究结果首次揭示了+TAMs在调节肿瘤免疫逃逸中发挥的关键作用,为理解TAMs在调节抗肿瘤免疫中的作用提供了新的视角;并且,团队研发的抗单克隆抗体(已申请国家发明专利),首次探索阻断免疫检查点抑制剂的增敏作用,为结直肠癌联合免疫治疗策略的发展提供了新方向。
研究背景
01
免疫疗法的出现开创了癌症治疗的新时代。 尽管如此,结直肠癌(CRC)患者对免疫治疗获益的临床需求尚未得到满足。 目前,只有错配修复缺陷或微卫星不稳定性高 (MSI-H) CRC 亚组受益于免疫检查点抑制剂 (ICIs)。 然而,MSI-H CRC 仅占所有 CRC 病例的 15%。 在晚期结直肠癌中,比例更低,仅占4%~5%。 因此,仍然迫切需要进一步扩大结直肠癌免疫治疗,以使更广泛的患者群体受益。
肿瘤微环境(TME)是肿瘤免疫治疗耐药的重要介质。 许多研究表明,TME中的多种免疫抑制细胞与免疫治疗耐药密切相关。 例如,骨髓细胞可以通过直接配体-受体结合、释放可溶性抑制性细胞因子以及隔离必需的 T 细胞氨基酸来抑制 T 细胞功能。 因此,减轻TME中的免疫抑制是提高免疫治疗效果的重要手段。
巨噬细胞是结直肠癌中观察到的最丰富的免疫细胞之一,那些浸润 TME 的细胞通常被定义为肿瘤相关巨噬细胞 (TAM)。 高 TAM 密度与多种癌症的不良预后相关,但其在 CRC 中的作用存在争议。 一项研究发现,CD68 TAM 浸润到肿瘤前部与 CRC 患者生存率的提高相关。 然而,在另一项研究中,CD68 TAM 密度并不是重要的预后生物标志物。 这种相互矛盾的数据归因于巨噬细胞的高可塑性。 TAM 可以极化为促炎 M1 或抗炎 M2 表型。 然而,肿瘤中的 TAM 通常会被肿瘤细胞适应并极化为 M2 表型。 此外,M2-TAM 通过多种机制抑制细胞毒性 T 细胞。 M2-TAM发挥其免疫抑制作用的最重要方式是诱导T细胞耗竭。 当 T 细胞耗尽时,它们会表现出增殖潜力的丧失、效应器功能的减少和改变以及抑制性受体 (IR) 的共表达增加。 如何抑制或逆转TME中T细胞耗竭是一个需要深入研究的问题。
研究进展
02
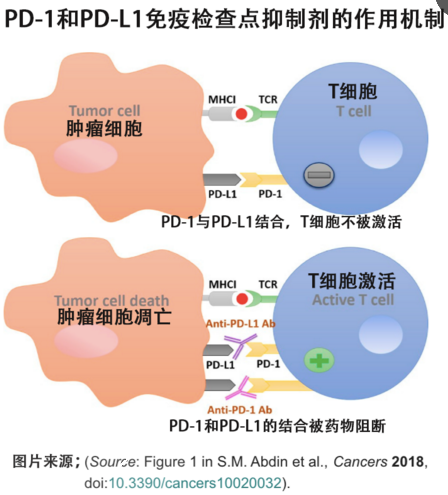
在这项研究中,我们发现抗疗法与抗PD-1治疗相结合,在抑制小鼠CRC生长方面具有协同作用。 此外,我们发现,即使肿瘤很大,这种联合治疗也能显着减缓肿瘤生长。 此外,我们发现,当抗/PD-1 疗法与 RT 相结合时,大的 CRC 肿瘤显示出显着的消退。 我们的研究结果表明,靶向巨噬细胞有可能成为结直肠癌联合免疫治疗的新靶点。
靶向肿瘤相关巨噬细胞恢复 CD8+ T 细胞介导的抗肿瘤免疫
CD20/MS4A1属于同一家族,在人类B细胞异常增殖期间得以维持。 针对 CD20/MS4A1 的单克隆抗体已显示出治疗复发性 B 细胞淋巴瘤的功效。 与B细胞中的CD20/MS4A1类似,它在人类TAM中高表达,并且其表达与多种癌症相关。 表达还与多血管炎等自身免疫性疾病有关。 因此,它被认为是开发治疗性单克隆抗体的合适靶点。 在这里,我们开发和设计了一种识别小鼠蛋白的抗体,并在动物实验中探索了这种抗单克隆抗体治疗结直肠癌的可行性。 值得注意的是,抗治疗并未对小鼠产生明显的毒性,这表明靶向治疗对于癌症治疗是安全的。 此外,我们发现它在多种癌症的TAM中特异性高表达,这意味着抗治疗药物可以应用于多种肿瘤。
意义
03
总而言之,我们的研究结果揭示了 TAM 在调节肿瘤免疫逃逸中的关键作用,并表明抗治疗可能有效提高抗 PD-1 治疗的疗效。 这些发现为理解TAMs在调节抗肿瘤免疫中的作用提供了新的视角,并为制定有效的CRC免疫治疗策略提供了新的方向。
参考:
注:本文旨在介绍医学研究进展,不能作为治疗方案的参考。 如需健康指导,请前往正规医院。







